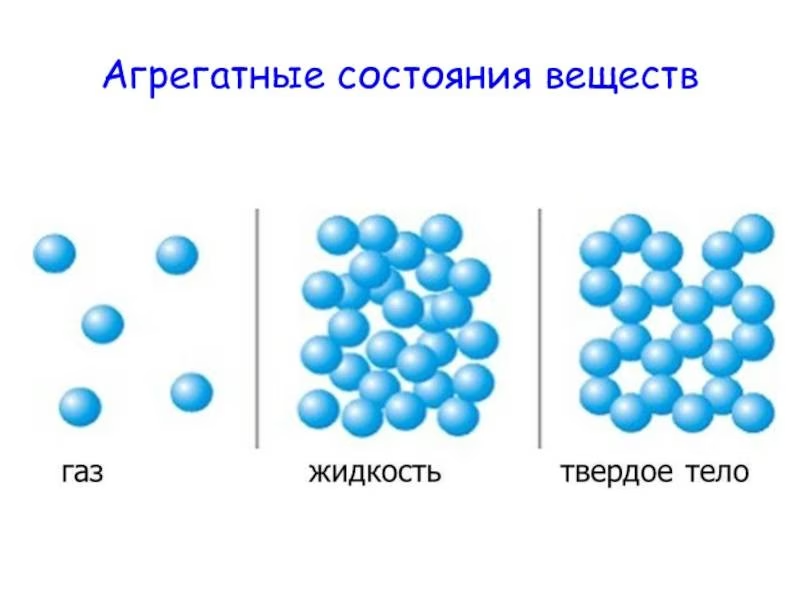
Агрегатные состояния вещества

ТРИ СОСТОЯНИЯ ВЕЩЕСТВА
Вещества
могут находиться в трёх основных агрегатных состояниях: твёрдом, жидком,
газообразном.
Силы взаимодействия между частицами (атомами, ионами или
молекулами), образующими вещество, обусловливают характерные свойства веществ в
разных агрегатных состояниях.